Т.М. Зимина, канд. физ.-мат. наук, В.В. Лучинин,
д-р техн. наук,
Е.В. Крапивина, аспирант, А.С. Ресин, аспирант,
Центр микротехнологии и диагностики, Санкт-Петербургский государственный электротехнический
университет
МИКРОСИСТЕМНАЯ ТЕХНИКА И ПРОБЛЕМЫ БИОМЕДИЦИНСКОГО АНАЛИЗА
![]()
(Продолжение.
Начало статьи № 2, 2000)
|
Приведен обзор аналитических микросистем для биомедицинского анализа. Рассмотрены особенности технологии и функциональные элементы аналитических микросистем, промышленные образцы, примеры применения. |
Основные технологии изготовления капиллярных микрочипов
Часть II. Функциональные компоненты аналитических микросистем
Компоненты термообработки (термоциклирования)
Контрольно-измерительные датчики
Примеры интеграции различных компонентов в единую микроаналитическую систему
Часть III. Состояние промышленных
разработок
Основные технологии изготовления капиллярных микрочипов
КАМС могут изготавливаться из стеклянных, кварцевых, кремниевых, полимерных или иных субстратов с каналами и отверстиями для заполнения чипа рабочими растворами, введения пробы и реагентов. Металлизация используется с целью создания электродов, подводящих высокое напряжение для электрофореза и управления потоками жидкости.
К настоящему времени у нас и за рубежом разработан и реализован ряд основных конструкций КАМС, которые можно классифицировать как:
· полимерные (и стеклянно-полимерные) [20-22];
· стеклянные (кварцевые) [19, 22-24];
· кремниевые [25].
В последнее время наиболее перспективными считаются полимерные технологии, поскольку они позволяют существенно снизить стоимость изделий и перейти к выпуску одноразовых капиллярных чипов, для работы с "грязными" образцами при диагностике заболеваний (СПИД, гепатит).
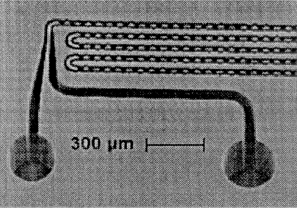
При изготовлении полимерных чипов используются технологии прецизионного литья, микрофрезерования, каландирования, ламинирования, лазерной микрообработки [20-22]. Показано, что полимерные субстраты могут соответствовать по качеству и геометрии поверхности требованиям, предъявляемым к КАМС. Так, на рис. 6 приведена фотография [26] планарного устройства, полученного методом литья под давлением из полиакрилата. Устройство обладает хорошими диэлектрическими свойствами и позволяет работать при напряженности электрического поля выше 1100 В/см, однако по сравнению с кремниевыми микрочипами наблюдалось плохое рассеяние тепла.
На рис. 7 представлен результат применения лазерной микрообработки для получения каналов в поликарбонатном субстрате [27]. Использовался УФ эксимерный импульсный лазер с импульсами 200 мДж. Получены также каналы в полистироле, ацетате целлюлозы, полиэтилентерефталате.
|
|
|
| Рис. 6. Микрофотографии полиакрилового капиллярного
микрочипа, полученного методом прецизионного литья: | Рис. 7. Микрофотография полимерного микрочипа, изготовленного методом лазерной микрообработки поликарбонатного субстарата. Показан вход в микроканал, образовавшийся в зазоре между субстратом с каналами и полиэтнлентерфталатной ламинарной пленкой, примененной для герметизации канала (увеличение 800х) [27] |
Часть II. Функциональные компоненты аналитических микросистем
В зависимости от конкретных задач архитектура микросистемы может изменяться. Например, КАМС для генного анализа включает следующие компоненты: капиллярную систему, инжектор, микроклапаны, амплификатор (ПЦР-реактор), теплообменник, источник возбуждающего излучения и датчик флюоресценции, источник питания, микропроцессорный модуль. Рассмотрим более подробно некоторые из компонентов (табл. 2).
Таблица 2. Компоненты аналитических систем на основе МСТ (КАМС)
|
Функциональные компоненты | Конструкторское решение |
| 1. Компоненты микрогидравлики | |
| а. Транспортно-разделительная капиллярная система на полимерном чипе (Центр микротехнологии и диагностики СПбГЭТУ). |
|
|
Применение. Электрофоретический анализ проб (пептидов, белков, аминокислот, фрагментов ДНК), иммуноанализ. | |
| б. Статические смесители [29]. |
|
|
Применение. Повышение эффективности смешивания при поточно-инжекционном анализе, образовании ферментных комплексов, связывании с флюоресцентными метками | |
| в. Дозатор "инжекционный крест" [30]. |
|
|
Применение. Дозированный вывод пробы в разделительный канал. | |
| 2. Концентрирующие компоненты [31] | |
| а. Матрица микроструктур с высокой площадью поверхности. |
|
|
Применение. Экстрагирование, очистка и концентрирование ДНК из биологических проб. | |
| б. Микрочип, содержащий матрицу микроструктур с высокой площадью поверхности. |
|
|
Применение. Экстрагирование, очистка и концентрирование ДНК из биологических проб. | |
| в. Электронная фотография поверхности чипа для экстракции ДНК из биологической пробы. |
|
|
Применение. Экстрагирование, очистка и концентрирование ДНК из биологической пробы. | |
| 3. Компоненты термообработки | |
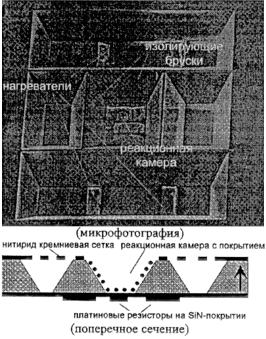
| а. Реакционная микрокамера [33]. |
|
|
Применение. Амплификация нуклеиновых кислот с помощью полимеразной цепной реакции. | |
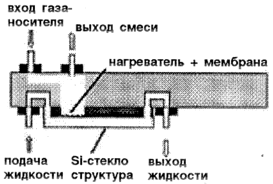
| б. Микроиспаритель [34]. |
|
|
Применение. Испарение жидких компонентов в газовый носитель. | |
| в. Теплообменник [35]. |
|
|
Применение. Низкоинерционный газовый теплообменник. | |
| 4. Микронасосы | |
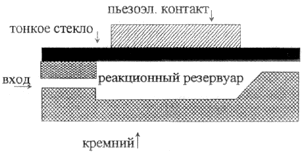
| а. Микронасос с пьезоэлектрическим активатором [36]. |
|
|
Применение. Дозированный ввод малых объемов компонентов. | |
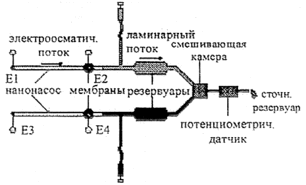
| б. Микроаналитическая система для объемного титрования с электроосмотическим насосом [37]. |
|
|
Применение. Ввод пробы в систему для объемного титрования с постоянной скоростью и высокой степенью равномерности. | |
| 5. Контрольно-измерительные датчики | |
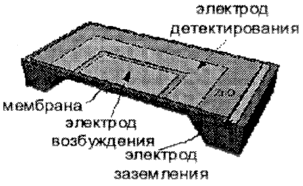
| а. Пьезоэлектрический микромембранный резонатор [38]. |
|
|
Применение. Определение плотности и вязкости компонентов в каналах микроаналитической системы. | |
| б. Температурный датчик потока [39]. |
|
|
Применение. Измерение скорости потока компонентов в каналах микроаналитической системы. | |
Компоненты микрогидравлики
Капиллярная сеть КАМС обеспечивает транспортные функции при проведении анализа за счет электроосмотического, гидростатического течений или электрофоретического движения молекул. К ним относятся дозирование, перемешивание проб и реагентов, разделение многокомпонентных проб по хроматографическому или электрофоретическому механизму. В качестве примера можно привести стеклянный чип для капиллярного электрофореза, изготовленный в Oak Ridge National Laboratories (США) и чип из полиметилметакрилата (табл. 2,1а и рисунки 8-9), изготовленный в Центре микротехнологии и диагностики СПбГЭТУ.
|
|
|
Рис. 8. Конструктивное решение стеклянного чипа и его узел для электрофореза (разработка Центра микротехнологии и диагностики СПбГЭТУ) |
|
|
| Рис. 9. Чип и его деталь в рабочем состоянии |
Топология транспортно-разделительных магистралей чип-анализатора должна обеспечивать:
· наличие резервуаров для ввода пробы, реагента и буферного раствора;
· прямоугольное пересечение каналов, образующих "инжекционный крест", осуществляющий смешивание и дозированный ввод пробы.
· наличие разделительного канала, в котором происходит фракционирование и съем информации;
· пересечение каналов под углом при смешивании реагентов.
Типовые габариты каналов: ширина 50…120 мкм, глубина 5...20 мкм.
Одним из требований к жидкостной микросистеме является обеспечение предварительной обработки образца реагентом. Но низкие скорости потока не позволяют создать условия для конвективного смешивания и оно осуществляется посредством диффузии. Для такого перемешивания в малом объеме, а также для предотвращения внешних воздействий применяют статические смесители [29], выполненные в виде особых геометрических неоднородностей микрометрового размера в капилляре чипа (табл. 2,1б). Такие смесители стимулируют образование вихревого течения, разворачивая тем самым слой жидкостей так, чтобы ускорить диффузионный обмен между ними. Принцип образования вихрей основан на создании любой преграды для побуждения вращения потока вокруг оси направления движения.
Компоненты, осуществляющие ввод дозированного объема пробы и реагентов, могут быть выполнены в виде "инжекционного креста" (табл. 2,1в), т.е. пересечения каналов, которое позволяет осуществлять дозированный ввод пробы в разделительный капилляр путем электрического регулирования направления потоков [30].
Концентрирующие компоненты
Одно из следствий миниатюризации – малые объемы образца. Это может быть как существенным преимуществом, например, в случае клинического мониторинга, так и создавать определенные проблемы, например, приводить к недостаточной чувствительности детектирования. Объем образца, необходимый для того, чтобы можно было провести детектирование, определяется следующим выражением [31]:
![]() , (5)
, (5)
где
![]() –
эффективность используемого сенсора (
–
эффективность используемого сенсора (![]() );
); ![]() – число Авогадро;
– число Авогадро; ![]() – концентрация анализируемого вещества (моль/л).
Иными словами, необходимый объем образца определяется как эффективностью сенсора,
так и концентрацией детектируемого вещества.
– концентрация анализируемого вещества (моль/л).
Иными словами, необходимый объем образца определяется как эффективностью сенсора,
так и концентрацией детектируемого вещества.
Manz A. et al. [32] проанализировали возможности использования очень малых объемов образца и пришли к выводу, что использование микроаналитической техники возможно при решении многих задач диагностики, так как ряд диагностически значимых соединений присутствуют в пробах в концентрациях от 108 до 1021 ед/мл и, исходя из формулы (5), могут детектироваться при объеме образца в пределах 10-12...10-6 л. Однако большинство диагностически значимых веществ присутствуют в пробе в более низких концентрациях (от нескольких единиц до 107 ед/мл) и их детектирование выходит за пределы области теоретически достижимой чувствительности [32]. Эта проблема решается использованием концентраторов. Одно из решений – создание микроструктур с высокой площадью поверхности для концентрации ДНК [31]. В табл. 2,2а представлена электронная микрофотография поверхности для захвата ДНК на основе оксидированного кремния, изготовленной методом глубокого реактивного ионного травления.
Экстрагирование, очистка и концентрирование нуклеиновых кислот из сложных биологических образцов являются первым шагом в генном анализе. Этот шаг весьма важен, так как нуклеиновая кислота в любом живом организме надежно защищена внутри клетки. При разрушении клетки (клеточный лизис) ее нуклеиновая кислота переходит в раствор, где могут присутствовать другие биологические молекулы, например, белки и комплексы металлов (например, Fe2+ гемоглобина), которые связывают нуклеиновую кислоту и ингибируют полимеразную цепную реакцию (ПЦР) амплификации. Поэтому нуклеиновая кислота должна быть изолирована, а ингибиторы смыты. При протекании образца через матрицу таких микроструктур ДНК, растворенная в образце, связывается с поверхностью микроструктур, концентрируется там и затем может быть вымыта специальным раствором значительно меньшего объема. Непрерывный поток жидкого биологического препарата сквозь матрицу таких концентраторов (табл. 2,2б, 2в) приводит к постепенному накоплению нуклеиновой кислоты на больших площадях SiО2-поверхности.
Компоненты термообработки (термоциклирования)
Представленный подход к MAC позволяет решать многие задачи, связанные с термической обработкой образца. Например, метод амплификации ДНК путем проведения ПЦР требует циклического нагрева и охлаждения образца. Высокая тепловая изоляция и низкая масса, достижимые благодаря миниатюризации тепловых компонентов жидкостных систем, могут значительно уменьшить требуемую мощность и значения тепловых констант системы и ускорить процесс термоциклирования при проведении ПЦР. В процессе проведения ПЦР смесь образца с набором специальных ПЦР-реагентов подвергается режиму циклического изменения температуры, при котором требуемый участок ДНК удваивается в течение каждого температурного цикла. Для эффективного и быстрого переноса теплоты желательно иметь систему с низкой теплоемкостью, которая обеспечивает быстрый нагрев жидкости и быстрое ее охлаждение. В качестве примера можно привести кремниевую микрокамеру для амплификации ДНК (табл. 2,3а) [33]. Реакционная камера термически изолирована от субстрата с помощью четырех "брусков". В качестве нагревателей используются резистивные элементы, нанесенные по бокам реакционной камеры. Они передают теплоту непосредственно к кремниевым стенкам микрокамеры. Температурным датчиком служит платиновый резистор, нанесенный на внешнюю сторону дна камеры. Во время стадии охлаждения теплота передается из камеры к подложке, которая имеет постоянную низкую температуру. Система характеризуется термической временной постоянной
![]() ,
(6)
,
(6)
где ![]() – теплоемкость камеры;
– теплоемкость камеры; ![]() – термическое сопротивление между камерой и подложкой.
Теплоемкость камеры определяется соотношением
– термическое сопротивление между камерой и подложкой.
Теплоемкость камеры определяется соотношением
![]() ,
(7)
,
(7)
где ![]() ,
, ![]() – плотность и удельная теплоемкость содержимого
камеры соответственно;
– плотность и удельная теплоемкость содержимого
камеры соответственно; ![]() – объем кремниевой камеры.
– объем кремниевой камеры.
Термическое сопротивление между камерой и окружающим субстратом определяется соотношением
![]() ,
(8)
,
(8)
где
![]() – теплопроводность кремния,
– теплопроводность кремния, ![]() – поперечное сечение брусков,
– поперечное сечение брусков, ![]() – длина брусков. В камере такой конструкции
– длина брусков. В камере такой конструкции ![]() может быть порядка долей секунды.
может быть порядка долей секунды.
Для решения определенных задач аналитические микросистемы могут содержать и другие компоненты термообработки, такие как микроиспарители, теплообменники. В табл. 2 представлены схемы микроиспарителя (3б) [34] и параллельного проточного теплообменника (3в) [35], изготовленных методами микротехнологии.
Микронасосы
Одним из важных компонентов КАМС являются микронасосы, необходимые для транспортирования образцов и реагентов. Для доставки небольших количеств пробы в локализованный участок используются различные типы и конструкции микронасосов. В табл. 2,4а представлена схема пьезоэлектрического микронасоса [36]. В кремниевом субстрате вытравливаются небольшая полость и каналы. Затем к кремнию анодированием прикрепляется тонкая стеклянная мембрана, герметизируя эту полость и формируя резервуар с узкими выходным и входным каналами. Далее входное отверстие погружается в жидкость, которая за счет капиллярного эффекта поднимается в резервуар до тех пор, пока не достигнет конца выходного канала. Когда электрическое поле приложено к пьезоэлектрическому элементу, соединенному со стеклянной мембраной, мембрана прогибается в полость и вытесняет жидкость. Насосы могут работать с частотой до нескольких килогерц и образовывать капельки жидкости объемом 100 пл.
Для систем проточного инжекционного анализа, капиллярного электрофореза и хроматографии постоянная скорость потока и его равномерность являются необходимыми требованиями. В табл. 2,4б представлено схематическое изображение КАМС, содержащего микронасосы с электроосмотическим принципом действия для осуществления процедуры объемного титрования [37]. Электроосмотический поток между электродами Е1 и Е2 осуществляет доставку раствора образца в смешивающую камеру, в то время как второй поток между электродами ЕЗ и Е4 откачивает оттитрованный раствор. В равновесном состоянии, т.е. без внешнего гидростатического давления, электроосмотическое давление, создаваемое таким насосом, описывается отношением:
![]() , (9)
, (9)
где
![]() – электроосмотическая подвижность;
– электроосмотическая подвижность; ![]() – вязкость;
– вязкость; ![]() – длина микроканала насоса;
– длина микроканала насоса; ![]() – напряженность электрического поля;
– напряженность электрического поля; ![]() – эффективный радиус микроканала.
– эффективный радиус микроканала.
Объемная скорость потока в канале может быть найдена из соотношения
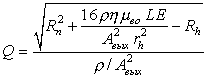 ,
(10)
,
(10)
где ![]() – гидравлическое сопротивление канала;
– гидравлическое сопротивление канала; ![]() – плотность жидкости;
– плотность жидкости; ![]() – поперечное сечение канала.
– поперечное сечение канала.
Контрольно-измерительные датчики
Кроме представленных компонентов, значительный интерес представляет интегрирование в КАМС различных анализирующих датчиков: скорости потока, рН, ионной силы, вязкости, оптической плотности и др.
В табл. 2,5а представлена схема пьезоэлектрического микромембранного резонатора для определения плотности и вязкости жидкости [38]. Резонатор состоит из монокристаллического Si-слоя толщиной 4,6 или 6,6 мкм, покрытого слоем SiO2 толщиной 0,1 мкм. Структура типа сэндвича (0,6 мкм Аl; 2,4 мкм ZnO и 0,3 мкм Аl) формирует электрод заземления, пьезоэлектрический слой и электроды возбуждения и детектирования. Центральный электрод используется для возбуждения поперечных вибраций мембраны, в то время как электрод вдоль края мембраны применяется для детектирования вибрации. Жидкость находится в контакте с обратной стороной мембраны, изменяя частоту и добротность этой колебательной системы. По этим параметрам определяют вязкость и плотность жидкости.
В табл. 2,5б представлено изображение термического датчика потока [39]. Датчик состоит из нагревателя в виде спирали и двух термозондов в виде спиралей прямоугольной формы, расположенных симметрично по бокам от нагревателя. Датчик находится на дне проточного канала, один термозонд расположен выше по течению канала, другой – ниже. Датчик измеряет зависящую от скорости потока конвективную теплопередачу от нагревателя через поток к двум термозондам. Используя различные методы температурной модуляции, можно достичь высокой точности измерения и независимости от возмущений.
Датчики и другие компоненты, интегрируемые в микроаналитические системы, могут иметь разнообразные конструкторские решения и использовать различные принципы действия.
Примеры интеграции различных компонентов
в единую микроаналитическую систему
|
|
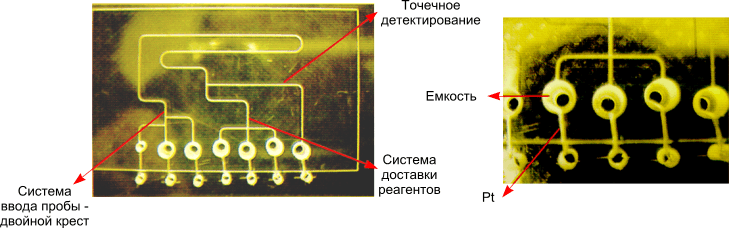
| Рис. 10. Реализация капиллярной системы LabChip ("Caliper Technologies", 1998) |
Понятно, что интеграция в единое устройство различных компонентов является важной задачей для разработчиков микроаналитических систем и определяется функциональным назначением создаваемой системы. На рис. 10 представлена одна из возможных реализаций капиллярной микроаналитической системы LabChip, разработанная компанией "Caliper Technologies". Капиллярная система выполнена с помощью технологии фотолитографии и жидкостного травления. Ширина каналов 70 мкм, глубина 10 мкм.
Фирмой продуман и разработан пользовательский интерфейс, связывающий чип с "внешним" миром. LabChip может использоваться для изучения ферментной кинетики, ферментативного ингибирования, проведения электрофоретического разделения любых биологических объектов, имеющих различные электрофоретические подвижности, включая электрофорез фрагментов ДНК (в капилляр при этом вводится специальный гель, служащий молекулярным ситом). Получаемый уровень разрешения составляет одну пару оснований.
|
|
| Рис. 11. фотография микрочипа фирмы Nanogen и системы электрических контактов |
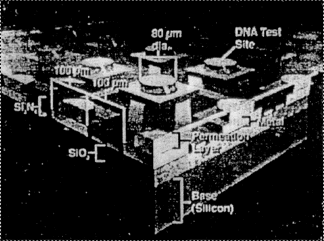
Примером успешного осуществления интеграции различных компонентов в логически завершенную автоматизированную систему является устройство, разработанное компанией "Nanogen Inc". Данное устройство включает в себя одноразовый картридж, содержащий полупроводниковый микрочип (рис. 11) и микропроцессорную систему для управления и съема информации. Устройство позволяет проводить анализ образцов ДНК посредством гибридизации (так называемое секвенирование посредством гибридизации, SBH). Микрочип в определенных местах покрывается специальным проницаемым слоем, который образует ряд "тестовых площадок" на поверхности чипа диаметром около 80 мкм (рис. 12). На каждой тестовой площадке чипа синтезируются олигонуклеотиды с известной последовательностью. Размер чипа с контактными дорожками от активной области (всего 25 электродов) 1 см´1 см. Разрабатывается чип с 100 и 400 тестовыми участками. Размер активной области 1 мм2.
|
|
| Рис. 12. Схематическое
изображение гибридно-интегрального аналитического микрочипа |
Так как возможен синтез различных олигонуклеотидов на разных тестовых площадках, и независимый потенциал может быть подан к каждой площадке, то возможно проведение комплексного и параллельного анализа.
Микрочип вставляется в полимерный одноразовый картридж, который содержит специальные каналы и резервуары для ввода и вывода реагентов, их промывки, электрические соединения, которые связывают чип с системой управления.
Автоматическая система съема информации состоит из высокочувствительного лазерного флюоресцентного сканера для детектирования связанных молекул; флюидной системы, осуществляющей перемещение реагентов и пробы, а также производящей процессы промывки чипа и картриджа; компьютерного обеспечения, осуществляющего выбор режима анализа, контроль за проведением детектирования, обработку данных.
Оператор просто вставляет картридж, содержащий тестируемый образец в устройство. Затем все процессы осуществляются автоматически. 96-канальное устройство для капиллярного электрофореза, выпущенное фирмой IMM, позволяет проводить параллельный анализ образцов для массового скрининга новых лекарственных препаратов. Другая сверхвысокопроизводительная система представлена недавно фирмой Caliper. Эта система разработана специально для фармацевтических компаний.
Часть III. Состояние промышленных разработок
Революция в биомедицинском анализе, связанная с использованием аналитических микрочипов, вызвала определенный "ажиотаж" в области аналитического приборостроения, обеспечивающего биохимию, генный анализ и диагностику, что привело к возникновению целого ряда специализированных приборостроительных фирм (табл. 3). С 1993 г. по настоящее время в США создано более десятка компаний в развитие которых за это время (по данным пресс-релизов этих фирм) вложено около 400 млн долларов из различных источников, причем примерно половина средств обеспечена государством.
В области матричных чипов (или гибридизационных чипов) наиболее "старыми" фирмами являются "Affimetrix" и "Nanogen" (Калифорния, США), созданные в 1993 г. Фирма "Affimetrix" разрабатывает исключительно гибридизационные чипы для анализа ДНК. К настоящему времени фирмой "Affimetrix" создана аналитическая система GeneChip Integrated System, которая автоматически вводит и анализирует целевую нуклеиновую кислоту (независимо может исследовать четыре образца), фокусирует возбуждающее излучение в 3-мкм точках в каждой из ячеек матрицы. Изображение матрицы высокого разрешения генерируется в реальном времени и записывается в файл первичных данных, которые обрабатываются и могут легко переводиться в другие информационные системы.
Таблица 3. Технологический профиль ведущих фирм, реализующих МСТ-концепции в биомедицинском анализе
|
Название и расположение фирмы |
Основные направления работы |
Продукция |
|
"Caliper Technologies" (США) |
Лаборатории на чипе. Системы для высокопроизводительного скрининга для разработки лекарственных препаратов, лечения и выполнения более дешевых биологических и генетических исследований. Микрофлюидные капиллярные стеклянные и полимерные чипы, которые функционируют как интегральные схемы. Они работают с жидкими фазами, содержащими ДНК, белки или клетки, как полупроводники работают с электронами. Это ускоряет процессы анализа |
LabChip™ systems: системы для высоко-производительного скрининга с анализом данных и сохранением в базах данных для пользователей. Agilent 2100 Bioanalyzer. Первая персональная аналитическая система, состоящая из Agilent 2100 Bioanalyzer и технологии LabChip. High Throughput Screening System: высоко-производительная система скрининга, использующая чипы с нанолитровым объемом; используется меню различных чипов для фармакологических анализов |
| "Orchid Biocomputers" (США) |
Технологии, схожие с работой компьютерных чипов для создания микроскопических станций по управлению жидкостями для разработки лекарств. Чипы проводят тысячи химических реакций одновременно. Они применяются вместе с комбинаторной химией и высокопроизводительным анализом. Применение: параллелизация; микрофабрикация для создания трехмерных структур реакторов и флюидных транспортных каналов; планарные процессы; микросенсорные линейки для мониторинга реакций |
The 144 Work
Station – лабораторная модель. SNP stream. SAGIAN Core System |
|
"Cepheid" (США) |
Анализ патогенных факторов, а также ДНК, крови, мочи, тканей, пищи. Аминокислотный анализ. Высокопроизводительные переносные анализаторы для солдат. Технологии PCR в микроварианте. Полностью автоматизированные анализаторы ДНК. Переносной прибор, который может быть использован в полевых условиях. Быстрые химические реакторы |
I-CORE&trade- высокопроизводительные реакционные трубки для PCR. Smart Cycler&trade 8-канальная приставка, которая испытывается в лабораториях. microBE&trade
– портативный прибор. microDiagnostics&trade |
|
"Affimetrix" (США) |
Высокоскоростные системы анализа генной информации, ее обработки, систематизации в базах данных. VLSIPS Микрочип для изучения мутаций мембранного гена регулятора человеческого цистического фиброза (CFTR) с использованием реакции мультиплексной Polymerase Chain Reaction (PCR) и системы GeneChip Микротехнологии, гибридизационные чипы, компьютерные программы для систематизации данных, флюидика |
GeneChip Instrument System: станция флюидики сканер генных матриц рабочая станция информационная система (лабораторная система для работы с информацией, система поиска данных по экспрессии). Чипы: GeneChip p53, CYP450 |
|
"Hyseq" (США) |
Открытие генов. Лицензирование генов. Открытие полиморфизма. Ускорение молекулярных процессов. Мультифункциональность анализа одной пробы. Гибкая архитектура, позволяющая варьировать функциональность матриц. SBH (сиквенирование путем гибридизации)1. Высокая производительность (1М образцов/месяц). Создание библиотек генов. Высокая точность сиквенирования. Универсальные ДНК микроматрицы, разработанные совместно с Перкин-Елмер |
HyChip System: – процесс для исследования последовательности ДНК с 1024 5-мерными олигонуклеотидами. HyGnostics Platform |
|
1SBH – гибридизация меченых проб ДНК с известной последовательностью и неизвестных проб ДНК. По завершению процесса гибридизации присоединившиеся последовательности могут быть расшифрованы или получено их "факсимиле", которое может быть помещено в библиотеку генов, для более поздней расшифровки. | ||
|
"Nanogen" (США) |
Генные исследования с использованием чипов с открытой архитектурой. Диагностика инфекционных заболеваний и фармакогенетика. Технология, интегрирующая микроэлектронику и молекулярную биологию на патентованных микрочипах. Используется активная микроэлектроника для транспортирования и концентрации заряженных молекул на специальных активных площадках в полупроводниковом микрочипе. Ключевые партнеры – Becton Dickinson по диагностике инфекционных заболеваний, Elan по генному анализу и Hochst AG по разработке лекарств |
Nanogen – полностью автоматизированный прибор. Состоит из высокочувствительного лазерного флюоресцентного сканера (сканирование матриц с 100 точками за 2 минуты, флюоресценция детектируется от менее чем 500 молекул) и жидкостной системы, с полностью автоматизированным движением реагентов на одноразовом чипе. Включает прецизионные шприцевые микронасосы, держатель чипа и жидкостные коммуникации, компьютер и программу для управления анализом и обработки данных |
| "Aura Daignostics" (Великобритания) |
Микрофлюидика |
|
| "ACLARA" (США) |
Микрогидравлические устройства для генного анализа, мониторинга лекарств, клинической диагностики. Активная микрофлюидика и интегральная химическая переработка. Полимерные чипы. Разделение в полимерных чипах |
LabCard CHIP-PCR CHlP-electrophoresis |
|
"Aurora Biosciences Corporation" (США) |
Компьютерное управление процессом ультравысокоскоростного скрининга (включая обычные 96-и 384-ячеечные блоки). Микрофлюидика для быстрой доставки. Флюоресцентный анализ. Система генного анализа с репортером
на основе Полностью автоматизированные высокопроизводительные системы скрининга (1000000 компонентов), 100000 в день для первичного скрининга и 2000 для повторного скрининга |
UHTSS – ультравысокопроизводительная система скрининга (завершение в 2000 г.) NanoPlates – платформа для скрининга с 3456 миниатюрными ячейками. К ним станция микрофлюидики, флюоресцентный детектор, информационная система |
| "Microtech" (Великобритания) |
Концепция биофабрики на чипе. Работа на стыке биологии и микроэлектроники. Использование электроосмотической флюидики для анализа клеток, микроорганизмов и других биочастиц (бактерий, паразитов, вирусов, хромосом, биомакромолекул – ДНК и белков), синтетических частиц. Диэлектрофорез. Электроротация. Диэлектрофорез с плавающей волной. Лазерные технологии. Анализ электрических полей. Цифровой процессинг изображений. Применение неоднородных полей, пондомоторных сил в воздействии на частицы |
Анализаторы на основе электроротации. Анализатор микробиологических загрязнений пищи |
Создана информационная система, включающая алгоритмы интерпретации первичной информации и связи данных с другими источниками генетической информации. Такие чипы применяются для анализа экспрессии, генотипирования и диагностики болезней. С 1996 г. компания активно сотрудничает с фармацевтическими фирмами по созданию стандартных методик генного анализа по изучению рака – ген р53 (рак груди, кишечника, яичников и других органов); созданию матриц для определения N. influenzae, S. pneumoniae; идентификации бактерий и изучению нечувствительности к антибиотикам; созданию тестов для клинической диагностики ВИЧ и его генных вариаций, новых баз данных и служб по изучению специфицированных болезней; исследованию корреляций между мутациями и ВИЧ вирусом. К 1997 г. уже объявлено о выпуске первого коммерческого продукта по генной диагностике мутаций, который полностью читает ген р53 сапрессанта опухолей. Объявлено о выпуске коммерческого набора для лабораторного анализа цитохрома Р450 (CYP450).
К 1998 г. объявлен выпуск расширенного портфеля продуктов GeneChip, включая матрицу высокой плотности, позволяющую анализировать уровни экспрессии 30000 генов и последовательностей и более 40000 человеческих генов.
"Nanogen" развивает технологию, интегрирующую микроэлектронику и молекулярную биологию на патентованных микрочипах. Эта фирма специализируется в генных исследованиях, используя возможности открытой архитектуры чипов. Этой фирме удалось к настоящему времени создать опытный образец автоматизированного прибора с высокочувствительным лазерным флюоресцентным сканером, где используются программы с распознаванием образов. Прибор проводит сканирование матриц с 100 точками за 2 мин. Флюоресценция детектируется при наличии не менее чем 500 молекул. Жидкостная система контролирует ввод пробы и промывку, осуществляя полностью автоматизированное движение реагентов на одноразовом чипе.
Продукция фирмы "HySeq" – это HyChip System – универсальные матрицы, разработанные совместно с "Perckin-Elmer", для исследования последовательности ДНК с 1024 5-мерными олигонуклеитидами. Система HyGnostics Platform создана для полной расшифровки ДНК на многих репликационных матрицах.
В 1996 г. учеными Стенфордского университета и Ливерморской национальной лаборатории создана фирма "Cerpheid" (Калифорния, США), концепция которой – применение достижений в микрофлюидике и микроэлектронике для создания революционных методов диагностики на основе анализа ДНК (концепция обозначена как microDiagnostics&trade). Компания разрабатывает полностью интегрированные портативные приборы и лабораторные системы для быстрого и эффективного детектирования инфекций, человеческих генов и экологических токсикантов в армейских условиях. Компания "Cerpheid" недавно объявила о внедрении в армию портативной системы анализа ДНК для определения загрязнений пищи, воды, идентификации патогенных бактерий на поле боя и криминалистического ДНК-анализа. Компания получила заказ Министерства обороны США на разработку миниатюрной полностью автоматизированной системы анализа ДНК для использования в различных сценариях лабораторной и полевой диагностики. Эта система должна явиться первым шагом по пути к ручным приборам для солдат на поле боя. Цель проекта – разработать анализаторы биологического оружия. Закончен первый этап работ по созданию портативного высокоскоростного ПЦР-термоциклера.
Фирма "Caliper Technologies" благодаря партнерству с "Hewlett-Packard", "Dow Chemical" и другими ведущими приборостроительными и химическими концернами, соединила несколько "интеллектуальных портфелей" и стала мировым лидером по технологиям "лаборатории-на-чипе". Разрабатываемая продукция – LabChip системы – позволяет осуществлять высокопроизводительный скрининг для разработки лекарственных препаратов, усовершенствования лечения и реализации более дешевых биологических и генетических исследований. Фирма получила фундаментальный патент на концепцию лаборатории-на-чипе. Благодаря сотрудничеству с "Dow Chemical" разработаны одноразовые полимерные чипы. К настоящему времени фирма выпустила на рынок первую систему с использованием капиллярных чипов – Agilent2100Bioanalyzer.
Несколько отличное направление развивает "Aurora Biosciences Corporation". Эта фирма разрабатывает полностью автоматизированные высокопроизводительные системы скрининга (UHTSS). Эти системы могут оперировать растворами в модулях для быстрого доступа. Они способны обработать 100000 соединений в день при первичном скрининге и 2000 при повторном скрининге и проверке перспективности соединений. Ключевая позиция компании – компьютерное управление процессом ультравысокоскростного скрининга.
Заключение
Из предыдущего раздела статьи видно, что технологии матричных гибридизационных чипов для генного анализа достигли коммерческого уровня. Медленнее превращается в потребительские продукты более наукоемкая область капиллярных (или микрофлюидных) чипов, в которой авторы данной статьи видят ниши для предложения оригинальных технических решений. Поэтому нам представляется необходимым более подробно рассмотреть области применения именно таких систем с учетом их преимуществ.
К настоящему времени описаны лабораторные системы КАМС для сепарации посредством капиллярного электрофореза [8,40,41], синхронизированного циклического электрофореза [42], свободно-поточного электофореза [43], электрохроматографии в открытом капилляре [13], мицеллярной электрохроматографии [44], электрофореза с применением ПЦЗ-реакторов на чипе [45], капиллярного изоэлектрофокусирования [46], электрофореза с постколоночными реакторами для визуализации [16] и др. Преимущества этих капиллярных анализаторов: компактная геометрия, скорость и параллельность анализа, низкая стоимость.
Основные направления анализа с использованием КАМС:
· генный анализ с применением ПЦР и капиллярного электрофореза;
· анализ белков;
· анализ пептидов;
· анализ олиго- и полисахаридов;
· иммунный анализ;
· анализ
электрофоретической подвижности, ![]() – потенциалов и распределения по размерам молекул
и частиц.
– потенциалов и распределения по размерам молекул
и частиц.
Перечислим те аналитические применения КАМС, которые непосредственно могут быть перенесены из области электрофореза и хроматографии в формат анализа на чипе [47].
Аналитическая биохимия и биомедицинский анализ: определение катеходаминов, гормонов, энзимов, идентификация изоэнзимов, идентификация аминокислот, пептидов и других биохимических маркеров, получение пептидных карт, анализ рестрикционных фрагментов ДНК, синтетических олигонуклеотидов, исследование фармакокинетики, определение нуклеотидной последовательности ДНК, генетический анализ, генотипирование, усовершенствование методов лечения, дешевые биологические и генетические исследования.
Например,
изготовлен микрочип, содержащий сосуды с ![]() – галактозидазой-субстратом, гидролизуемым в
флюоресцирующий продукт резоруфин [48]. Исследовалось ингигбирование реакции фенилэтил-
– галактозидазой-субстратом, гидролизуемым в
флюоресцирующий продукт резоруфин [48]. Исследовалось ингигбирование реакции фенилэтил-![]() -
-![]() -тиогалактозидом. Определение
энзима требует 20 мин, 120 пг энзима и 7,5 нг субстрата. По сравнению с обычным
анализом возможно уменьшить количество реагентов на четыре порядка.
-тиогалактозидом. Определение
энзима требует 20 мин, 120 пг энзима и 7,5 нг субстрата. По сравнению с обычным
анализом возможно уменьшить количество реагентов на четыре порядка.
Сконструирована
и изготовлена система для 12-канального капиллярного электрофореза для быстрого
(160 с) параллельного анализа образцов ДНК на примере диагностики наследственного
геохроматоза путем электрофореза рестрикционных фрагментов pBR322 Mspl DNA, окрашенных красным красителем-интеркалятором
(butyl TOTYN) с присоединением
в колонке метки thiazole orange [49]. Фрагменты детектировались
с помощью конфокального флюоресцентного сканера при возбуждении флюоресценции
лазером ![]() нм, 5 мВт и детектировании флюоресценции
нм, 5 мВт и детектировании флюоресценции
![]() нм
и
нм
и ![]() нм. Сканирующая система детектирования стала
в 10 раз чувствительней, чем при использовании РЗС-матрицы.
нм. Сканирующая система детектирования стала
в 10 раз чувствительней, чем при использовании РЗС-матрицы.
Иммунология: иммунодиагностика микроорганизмов и токсионов в объектах окружающей среды, болезней и патологических состояний, аллергенов. Имеются данные о применении микрочипов в иммуноанализе [50], например, интегральный иммунореактор представляет собой стеклянный микрочип, в котором реагенты и образец сыворотки для конкурентного иммуноанализа сывороточного теофиллина могут смешиваться для проведения реакции Устройство работает как автоматическая микрофлюидная система для иммуноанализа Образец сыворотки с меткой, теофиллином и антитеофиллин смешиваются в реакторе объемом 51 нл, а затем проба объемом 100 нл поступает в разделительный канал. Связанный и свободный трассер затем детектируются с помощью флюрометрического детектора Предел детектирования составляет 0,26 мг/л.
Разработана методика определения кортизола в крови на 96-канальном чипе с помощью электроферретического иммуноанализа [51]. Система позволяет проводить 200 000 анализов в сутки.
Фармацевтический анализ: определение подлинности и чистоты синтетических медикаментов, гормонов, антибиотиков, витаминов, изучение фармакокинетики, высокопроизводительный скрининг для разработки лекарственных препаратов, поиск биологически активных фракций при разработке лекарств методом комбинаторного синтеза/высокопроизводительного анализа, фармакогенетика.
Экологический анализ:
· определение промышленных экотоксикантов.
Экспертиза пищевых продуктов:
· определение подлинности продуктов и напитков, определение пищевых добавок, микотоксинов, биологических токсинов, бактерий.
Криминалистическая экспертиза:
· анализ наркотиков и лекарственных препаратов, идентификация с помощью генного анализа.
Список литературы
1. WoolleyA.T.,SensabaughG.E.,MathiesR.A. // Anal Chem 1997. V. 69
P 2181-2186.
2. Mangru S.D., Harrison D.J. // Electrophoresis
1998. V. 19. P. 2301-2307.
3. Effenhauser C.S„ Bruin G.J. M., Paulus
A. // Anal Chem 1997. V. 69. P. 3451-3457.
4. Effenhauser C.S., Manz A., Widmer H.M.
// Anal Chem 1993. V. 10. P. 2637-2642.
5. Jacobson S.C., Moore A.W., Ramsey J.M.
// Anal Chem. 1995. V. 67. P. 2059-2063.
6.
7. McCornick R.M., Nelson R.J., Alonso-Amigo
M.G., Benvegnu D.J., Hooper H.H. // Anal. Chem. 1997. V. 69. P. 2626-2630.
8. Roberts M.A., Rossier J.S., Gitault
P.B. // Anal. Chem. 1997. V. 69. P. 2035-2042
9. Koutny L., Schmalzing D.,
10. Petersen К., McMillan W., Kovacs G., Northrup A.,Chrostel
L., Pourahmadi F. The promise of miniaturized clihical diagnostic systems, IDV
Techology Magazine, Jul. 1998 (IVDT archive, htt://devicelink.corn/ ivdt/archive/98/07/009.htm).
11. Jacobson S.C., Herdenroder R., Koutny L.B., Wannack
R.J., Ramsey M. // Anal. Chem. Vol. 66, No. 7, April 1. 1994, pp. 1107-1113.
12. Petersen К., McMillan W., Kovacs G., Northrup A., Christel
L., Pourahmadi F. The promise ofminiatunaed clinical diagnostic systems // IDV
Technology Magazine, Jul. 1998 (IVDT archive, http://devicelink.corn/ ivdt/archive/98/07/009.htm)
13. Manz A. et al Miniaturised systems of total chemical
analysis: new concept of chemical detection // Sensors and actuators, В1(1-6): 244-248, 1990.
14. Daniel J.H„ Iqbal S.,
15. Blandin 0., Alepee Ch., van Lintel H„ Graber F.,
Bertetti J.M., Renaud Ph. A Mieroflow Liquid to Gas Converter, Proc. The 13th
Eropean Conference on Solid-State Transducers (Eurosensors 13),
16. Alepee Ch., Parrate L., Cousseau P., Vulpescu
L., Renaud Ph. Fast Heating and Cooling for Hight Tenperature Chemical Microreactors
// Proc. IMRET Conference, Frankfurt am Main, Germany, April 1999.
17. Blanc-hard A.P., Kaiser R.J., Hood L.E. // Biosensors
and Bioelectromcs,Vol. 11, No. 6/7, 1996, pp. 687-690.
18. Guenat O.T., Ghiglione D., Pasquier V., van der
School B.H., Morf W.E., de Rooij N.F. An Electro-Osmotically Driven Nanopump for
Volumetric Nanotitration Applications // Proc. The 13th Eropean Conference on
Solid-State Transducers (Eurosensors 13),
19. Kolletr S., Brand 0., Sarro P.M., Vellekoop M.J.,
Baltes H. Piezoelectric ZnO Membrane Resonators for Liquid Property Sensmg //
Там же, pp. 677-680 (19C1).
20. Bedo G., Fannasch H., Muller R. A Silicon Flow
Sensor for Gases and Liquids Using AC Measurements // Там же, pp. 887-890 (25P23).
21. Hfrrison D.J., Manz A., Fan Z. // Anal. Chem.
1992. V. 64. P. 1926.
22. Jacobson S.C., Ramsey J.M. // Anal. Chem. 1996.
V. 68. P. 720-723.
23. Buggraf N., Manz A., Widmer H.M. // J. High Resolut.
Chroma-togr. 1993. V. 16. P. 594.
24. Raymond D., Manz A., Widmer H.M. // Anal. Chem.
1994. V. 66. P. 2858-2865.
25. Von Heeren F., Veerporte E., Manz A. // Anal.
Chem. 1996. V. 68. P. 2044-2053.
26. Wooley A.T., Hadley D., Landre P. // Anal. Chem.
1996. V. 68. P. 4081-4086.
27. Jcobson S.C., Ramsay J.M. // Anal. Chem. 1997. V. 69. P. 3212-3217.
28. Беленький Б.Г., Зимина Т.М. // Научное приборостроение, 1999 (в печати).
29. Hadd A.G., Raymond D.E., HaIIiweII J.W. // Anal.
Chem. 1997. V. 69. P. 3407-3412.
30. Wooley A.T., Sensabaugh G.F., Mathies R.A. //
Anal. Chem. 1997. V. 69. P. 2181-2186.
31. Chiem N.H., Harrison D.J. // Clin. Chem. 1998.
V. 44. P. 591-598.
32. IMM
33. Ross P.L.,