К. Сааль1,2, В. Саммелсельг1, А. Лыхмус1, Е. Кууск3, С. Копанчук2, Г. Райдару2, Т. Ринкен3 и А. Ринкен2, Институты 1физики, 2органической и биоорганической химии, 3физической химии, Тартуский Университет
ИССЛЕДОВАНИЕ ИММОБИЛИЗАЦИИ ГЛЮКОЗООКСИДАЗЫ НА ПОВЕРХНОСТИ СЛЮДЫ
АТОМНО-СИЛОВОЙ МИКРОСКОПИЕЙ И КИНЕТИЧЕСКИМИ МЕТОДАМИ
![]()
|
Методами ферментативной кинетики и визуализацией с помощью
атомно-силовой микроскопии (АСМ) была исследована энзиматическая активность
глюкозооксидазы (Е.С 1.1.3.4), иммобилизированной на поверхности слюды. Активность
иммобилизированного энзима уменьшалась с уменьшением концентрации |
Введение
Широко используемые ферментативные биосенсоры обычно состоят из различных кислородных сенсоров в сочетаниях с различными оксидоредуктазами, которые поглощают молекулярный кислород при реакциях окисления разных компонентов. Оксидоредуктазы – это большой класс энзимов, в котором более чем 800 различных представителей [1], и одним из первых направлений их использования как биокатализаторов было применение в разработке биосенсоров [2]. Среди оксидоредуктаз глюкозооксидаза (Е.С 1.1.3.4), которая селективно катализирует реакцию окисления глюкозы кислородом, благодаря своей стабильности и высокой воспроизводимости результатов является хорошим примером для разработки ферментативных биосенсоров. Для эффективного использования биосенсоров необходимо активный энзим биосенсора зафиксировать на нерастворимом носителе, что делает возможным его многократное применение. Однако пока еще очень мало информации о том, где и как связывается энзим с твердой поверхностью носителя. В данном исследовании глюкозооксидаза иммобилизировалась на поверхности слюды при использовании различных условий активации слюды и связывания фермента. Поверхности полученных препаратов визуализировали с помощью атомно-силовой микроскопии (АСМ), данные анализировались и сопоставлялись с данными по активностям энзима, которые определяли кинетическими методами.
Методы
Иммобилизация
энзима. Свежесколотые листочки слюды (мусковит) (са 1´1 см)
силанизировались с помощью ![]() -аминопропилтриэтоксисилана
(от 0,0001% до 1%) в 95%-ном ацетоне по методике, описанной в [3]. Для
активации силанизированную слюду промывали ацетоном и инкубировали в течение
двух часов с 0,2% 1,4-фенилендиизоциа-натом в 10%-ном растворе
пиридин/диметилформамида. Поверхность промывалась метанолом, ацетоном, водой и
натрий-фосфатным буфером,
-аминопропилтриэтоксисилана
(от 0,0001% до 1%) в 95%-ном ацетоне по методике, описанной в [3]. Для
активации силанизированную слюду промывали ацетоном и инкубировали в течение
двух часов с 0,2% 1,4-фенилендиизоциа-натом в 10%-ном растворе
пиридин/диметилформамида. Поверхность промывалась метанолом, ацетоном, водой и
натрий-фосфатным буфером, ![]() . Для
иммобилизиции глюкозооксидазы ее добавляли (в концентрации от 50 нг/мл до
50 мг/мл) и оставляли инкубироваться на ночь в буферном растворе при 4°С.
Перед измерением на АСМ поверхность промывалась водой для устранения несвязавшихся
веществ и солей.
. Для
иммобилизиции глюкозооксидазы ее добавляли (в концентрации от 50 нг/мл до
50 мг/мл) и оставляли инкубироваться на ночь в буферном растворе при 4°С.
Перед измерением на АСМ поверхность промывалась водой для устранения несвязавшихся
веществ и солей.
Измерение
энзиматической активности. Активность глюкозооксидазы (из Asp. Niger, Sigma
Chemical Co.) измерялась электрохимически с помощью кислородного датчика типа
Кларка, в натрий-ацетатном буфере (0,1 моль/л, ![]() ) при 25°С и
при постоянном перемешивании [4]. Активность иммобилизированного энзима
определяли по динамике изменения силы тока датчика. Все статические и
кинетические параметры вычислялись исходя из ранее предложенной модели
интеграционного биосенсора [5] методом нелинейных корреляций.
) при 25°С и
при постоянном перемешивании [4]. Активность иммобилизированного энзима
определяли по динамике изменения силы тока датчика. Все статические и
кинетические параметры вычислялись исходя из ранее предложенной модели
интеграционного биосенсора [5] методом нелинейных корреляций.
Измерения на АСМ. Визуализация свежепросушенной поверхности слюды проводилась на АСМ (AutoProbe CP, Park SI) методом прерывистого контакта (ПК) на воздухе. При этом использовались кремниевые кантилеверы с коническими остриями от фирмы Ultralevers (Park SI). Скорость сканирования и расстояние между наконечником и поверхностью были оптимизированы так, чтобы поверхность образца не изменялась в процессе исследования и была хорошо отображена.
Результаты и обсуждение
Слюда была выбрана носителем энзимов по следующим причинам:
· она имеет идеальную поверхность для измерения на АСМ;
· есть возможность ковалентного связывания энзима;
· она очень перспективна при разработке биосенсоров.
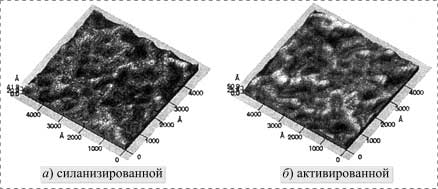
Поверхность свежесколотой слюды была почти совершенно
плоской и можно было провести четкую границу между обработанной и
необработанной слюдой. После силанизации слюды 1%-ным раствором ![]() -аминопропилтриметоксисилана
поверхность приобретала волнистую однородность с максимальной шероховатостью
4-6 нм (рис. 1,а). Средняя квадратическая шероховатость обработанной
поверхности составляла 0,6 нм, что относительно высоко, если сравнивать с
шероховатостью необработанной слюды (0,02 нм). Активация силанизированной
слюды 0,2%-ным раствором 1,4-фенилендиизоциа-ната незначительно изменяла
топографию поверхности (рис. 1,б), в то время как средняя квадратическая
шероховатость увеличивалась до 0,8 нм.
-аминопропилтриметоксисилана
поверхность приобретала волнистую однородность с максимальной шероховатостью
4-6 нм (рис. 1,а). Средняя квадратическая шероховатость обработанной
поверхности составляла 0,6 нм, что относительно высоко, если сравнивать с
шероховатостью необработанной слюды (0,02 нм). Активация силанизированной
слюды 0,2%-ным раствором 1,4-фенилендиизоциа-ната незначительно изменяла
топографию поверхности (рис. 1,б), в то время как средняя квадратическая
шероховатость увеличивалась до 0,8 нм.
|
|
|
Рис. 1. Трехмерное изображение поверхности слюды, ПК-АСМ, 500´500 нм |
После иммобилизации глюкозооксидазы на активированную слюду на ее поверхности появились большие неровности диаметром от 100 до 400 нм и высотой 50 нм (рис. 2). Это может означать, что во время иммобилизации энзимы образуют конгломераты значительных размеров, так как в естественных условиях димерные молекулы глюкозооксидазы имеют размеры 5´8 нм [6].
|
|
|
Рис. 2. Трехмерное изображение кластеров глюкозооксидазы |
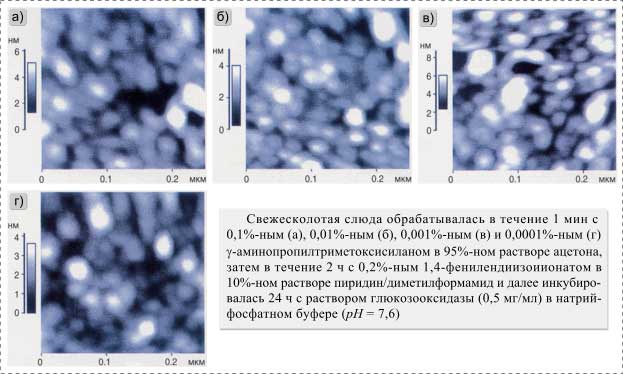
Уменьшение концентрации силанизирующего агента до 0,1% без каких-либо изменений в остальных этапах связывания привело к исчезновению больших конгломератов и показало большую однородность в насыщенности поверхности энзимом (рис. 3,а).
Аналогичная
насыщенность поверхности также наблюдалась и после дополнительного уменьшения
концентрации ![]() -аминопропилтриметоксисилана
до 0,0001% (рис. 3,а-г). Однако уменьшение концентрации силанизирующего
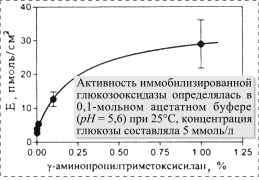
агента приводило и к уменьшению энзиматической активности иммобилизированной
глюкозооксидазы (рис. 4). Это означает, что объем, заполняемый энзимом на
обработанной поверхности слюды, непосредственно зависел от концентрации
-аминопропилтриметоксисилана
до 0,0001% (рис. 3,а-г). Однако уменьшение концентрации силанизирующего
агента приводило и к уменьшению энзиматической активности иммобилизированной
глюкозооксидазы (рис. 4). Это означает, что объем, заполняемый энзимом на
обработанной поверхности слюды, непосредственно зависел от концентрации ![]() -аминопропилтриметоксисилана,
используемого при первичной обработке поверхности, в то время как остальные
параметры процесса связывания оставались неизменными. Если принять, что во
время иммобилизации молекулы энзима в основном сохраняют свою естественную
структуру (в двухмерном пространстве), а 1 см2 поверхности
слюды, силанизированной
-аминопропилтриметоксисилана,
используемого при первичной обработке поверхности, в то время как остальные
параметры процесса связывания оставались неизменными. Если принять, что во
время иммобилизации молекулы энзима в основном сохраняют свою естественную
структуру (в двухмерном пространстве), а 1 см2 поверхности
слюды, силанизированной ![]() -аминопропилтриметоксисиланом,
содержит 29±7 пмоль глюкозооксидазы, что соответствует приблизительно 40%
максимально возможного мономолекулярного насыщения этой поверхности молекулами
энзима, то согласно выявленной зависимости (рис. 4), насыщенность, видимо,
не превышает 50%-го уровня даже при очень высокой концентрации силанизирующего
агента. Поэтому есть основания предполагать, что, по крайней мере, часть
поверхности покрыта белком, не обладающим каталитической активностью.
-аминопропилтриметоксисиланом,
содержит 29±7 пмоль глюкозооксидазы, что соответствует приблизительно 40%
максимально возможного мономолекулярного насыщения этой поверхности молекулами
энзима, то согласно выявленной зависимости (рис. 4), насыщенность, видимо,
не превышает 50%-го уровня даже при очень высокой концентрации силанизирующего
агента. Поэтому есть основания предполагать, что, по крайней мере, часть
поверхности покрыта белком, не обладающим каталитической активностью.
|
|
|
Рис. 4. Зависимость количества |
Сравнение кинетических констант показало, что ![]() равна 4,0 мкмоль О2/мин (на
1 мкмоль растворенного фермента) и 0,36 мкмоль O2/мин (на 1 см2
слюды) соответственно для растворенной и связанной с поверхностью слюды глюкозооксидазы.
При кинетических анализах также обнаружилось, что насыщенный раствор
глюкозооксидазы (Lot 76F-0188) содержал только 25% активных молекул от всего
количества энзима, т.е. специфическая активность фермента была 60000 ед/г
для данного образца.
равна 4,0 мкмоль О2/мин (на
1 мкмоль растворенного фермента) и 0,36 мкмоль O2/мин (на 1 см2
слюды) соответственно для растворенной и связанной с поверхностью слюды глюкозооксидазы.
При кинетических анализах также обнаружилось, что насыщенный раствор
глюкозооксидазы (Lot 76F-0188) содержал только 25% активных молекул от всего
количества энзима, т.е. специфическая активность фермента была 60000 ед/г
для данного образца.
Таким образом, беря в расчет реальную специфическую
активность энзима, мы можем утверждать, что максимальная насыщенность
поверхности, достигаемая при вариации концентрации ![]() -аминопропилтриметоксисилана,
составляет 200%. Это означает, что должны существовать дополнительные
вертикальные структуры в энзимном слое, которые выстраиваются из всех этих
молекул белка. Одним из объяснений может послужить то, что конгломераты белков,
показанные на рис. 2,
содержат дополнительное количество энзима, но поверхность этих структур не
достаточно велика для получения всей необходимой дополнительной активности.
Вместе с тем уменьшение концентрации силанизирующего агента уменьшает
количество активного энзима и при концентрациях, меньших 0,1%, тогда как при
этих условиях не наблюдались видимые изменения в насыщенности поверхности
энзимом. Таким образом, можно предположить, что существуют дополнительные
вертикальные структуры, образуемые
-аминопропилтриметоксисилана,
составляет 200%. Это означает, что должны существовать дополнительные
вертикальные структуры в энзимном слое, которые выстраиваются из всех этих
молекул белка. Одним из объяснений может послужить то, что конгломераты белков,
показанные на рис. 2,
содержат дополнительное количество энзима, но поверхность этих структур не
достаточно велика для получения всей необходимой дополнительной активности.
Вместе с тем уменьшение концентрации силанизирующего агента уменьшает
количество активного энзима и при концентрациях, меньших 0,1%, тогда как при
этих условиях не наблюдались видимые изменения в насыщенности поверхности
энзимом. Таким образом, можно предположить, что существуют дополнительные
вертикальные структуры, образуемые ![]() -аминопропилтриметоксисиланом
и используемые для иммобилизации энзима, но которые невозможно выявить методами
атомно-силовой микроскопии (АСМ).
-аминопропилтриметоксисиланом
и используемые для иммобилизации энзима, но которые невозможно выявить методами
атомно-силовой микроскопии (АСМ).
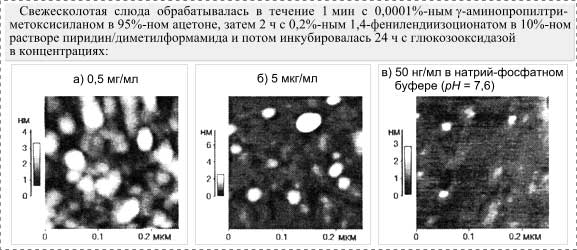
Уменьшение концентрации ![]() -аминопропилтриметоксисилана
до 0,0001% при первичной обработке поверхности слюды уменьшает энзиматическую
активность на поверхности до уровня, который ниже измеряемого кинетическими
методами предела, однако, как показано на рис. 3,г, поверхность по-прежнему полностью
заполнена белковой массой, которая не может быть индивидуально
охарактеризована. При одновременном уменьшении количества
-аминопропилтриметоксисилана
до 0,0001% при первичной обработке поверхности слюды уменьшает энзиматическую
активность на поверхности до уровня, который ниже измеряемого кинетическими
методами предела, однако, как показано на рис. 3,г, поверхность по-прежнему полностью
заполнена белковой массой, которая не может быть индивидуально
охарактеризована. При одновременном уменьшении количества ![]() -аминопропилтриметоксисилана
и концентрации глюкозооксидазы в процессе ее иммобилизации уменьшилась также и
насыщаемость поверхности молекулами, что сделало возможным достижение
молекулярного разрешения для энзима (рис. 5). Однако размерность обнаруженных субстанций, 10´10 нм и 3 нм в высоту
(рис. 5,в),
несколько отличается от той, которая ожидалась бы для чистой глюкозооксидазы
[6]. Следует отметить, что измерения проводились на воздухе, а при этих
условиях конформация энзима могла сильно измениться. Увеличение поперечных
размеров молекул также могло быть вызвано достижением предела разрешения для
АСМ, который зависит от реальных размеров остриев. Предполагая, что
иммобилизированные молекулы энзима представляют собой сферы диаметром
-аминопропилтриметоксисилана
и концентрации глюкозооксидазы в процессе ее иммобилизации уменьшилась также и
насыщаемость поверхности молекулами, что сделало возможным достижение
молекулярного разрешения для энзима (рис. 5). Однако размерность обнаруженных субстанций, 10´10 нм и 3 нм в высоту
(рис. 5,в),
несколько отличается от той, которая ожидалась бы для чистой глюкозооксидазы
[6]. Следует отметить, что измерения проводились на воздухе, а при этих
условиях конформация энзима могла сильно измениться. Увеличение поперечных
размеров молекул также могло быть вызвано достижением предела разрешения для
АСМ, который зависит от реальных размеров остриев. Предполагая, что
иммобилизированные молекулы энзима представляют собой сферы диаметром ![]() э
э![]() нм, и
беря в расчет то, что предполагаемый диаметр кончика острия для АСМ нм,
диаметр молекул энзима можно выразить как
нм, и
беря в расчет то, что предполагаемый диаметр кончика острия для АСМ нм,
диаметр молекул энзима можно выразить как ![]() э набл
э набл![]() э
э![]() нм
[7]. Такая же переоценка размеров молекул энзима проводилась и в других более
ранних исследованиях [8]. Улучшить положение можно, только уменьшив размеры
остриев для АСМ.
нм
[7]. Такая же переоценка размеров молекул энзима проводилась и в других более
ранних исследованиях [8]. Улучшить положение можно, только уменьшив размеры
остриев для АСМ.
Несмотря на проблемы с определением поперечных (боковых) размеров молекулы энзима отчетливо наблюдались на поверхности. Это означает, что простые методы, используемые для иммобилизации энзимов, позволяют (при подборе оптимальных концентраций и условий) визуализировать белки методом АСМ. Силанизационно-изотиоцианат-ная фиксация белка на поверхности слюды значительно быстрее и дешевле, чем применяемый метод абсорбции на поверхность золота [8] и, следовательно, может быть предложена для более широкого использования при визуализации белков методом АСМ. Это открывает новые перспективы для изучения процессов на поверхности твердых материалов с участием биомакромолекул.
Список литературы
1.
Enzyme
nomenclature database. www. expasy. ch/enzyme/.
2.
May S.W.
Current Opinion in Biotechnology. 1999. № 10. P. 370.
3.
Guo Z.,
Guilfoyle R.A., Thile A.J., Wang R., Smith L.M. Nucleic
Acids Res. 1994. № 22. P. 5456.
4.
Rinken Т., Rinken A., Jarv J.,
Tenno T. Biosensors & Bioelectronics. 1998. № 13. P. 801.
5.
Rinken Т., Tenno T. Biosensors &
Bioelectronics. 2000. № 16. P. 153.
6.
Rando D.,
Kohring G.W., Giffhorn F. Applied Microbiology and Biotechnology.
1997. № 48. P. 34.
7.
Heinrich K.F.J.
Electron beam X-ray microanalysis. Van Nostrand Reinhold Co.,
8. Losic D., Gooding J.J.,
Shapter J., Erokin P., Short K. 11th Australian Electrochemistry
Conference.
Работа проведена при финансовой поддержке Эстонского
Научного Фонда (гранты 4603 и 3871) и Эстонского фонда Инноваций (гранты
21 it и 18 kt).
| Наверх |